

目前国内流感疫苗渗透率低,与发达国家仍有巨大差距,国内流感疫苗仍存在巨大的成长空间。美莱德拥有完善的流感疫苗一站式生物分析服务,可对临床试验生物样本进行全流程监管,降低项目管理难度,提高研发效率,加速流感疫苗产品的上市进程,为流感疫苗的研发提供有力支持。


美莱德一站式流感疫苗研发服务,回顾请点击:
MED生物分析 | 美莱德流感疫苗研发一站式服务(一)—— HI法检测血清样本中HI抗体的检测流程及方法学验证
MED生物分析 | 美莱德流感疫苗研发一站式服务(二)—— 流感病毒中和抗体检测方法分享
MED生物分析 | 美莱德流感疫苗研发一站式服务(三)—— 病毒滴定检测:PCR法

流感病毒中HA 蛋白特异性IgG抗体检测主要基于酶联免疫吸附实验(ELISA)进行。ELISA作为免疫学经典实验方法,主要原理为将抗原固定在固相载体表面且保持其免疫学活性,测定时,受检标本(测定抗体)与固相载体表面的抗原特异性结合。用洗涤的方法使固相载体上形成的抗原抗体复合物与液体中的其他物质分开。再加入酶标记的抗原或抗体,也通过反应而结合在固相载体上。随后加入酶反应的底物进行显色,最后加入终止液终止反应,显色信号值与所结合的分析物量成正比,可根据显色的深浅进行定性或定量分析。

1、ELISA法检测流感病毒抗体
ELISA的操作一般都由以下几种基本的操作组合而成:将抗原或抗体吸附到固相载体上;封闭;加入待检样品以及后续试剂;温育;洗涤去掉游离未结合的反应物;加入酶检测底物;结果的判读。方法开发时可根据以上的步骤来对实验条件和试剂等进行挑选优化,以筛选出合适实验条件和试剂。
1.1 包被
固相载体:此步骤为将抗原或抗体吸附到固相载体上,包被的好坏直接影响到ELISA的灵敏度和特异性。固相载体的选择固相载体有多种多样的形式,它可以是微孔板、小试管等,其中96孔板是应用最广泛的形式,而针对吸附力的不同,又可分为高、中、低吸附力板。本实验选用costar的高吸附96孔板作为固相载体。
包被温度:一般来讲,温度越高,蛋白质的疏水作用就越明显,因此对于蛋白质抗原或抗体来说适当提高温度有利于包被的进行,但是温度过高会影响抗原或抗体的结构。一般包被都在37℃进行1-3小时,如果包被的温度较低,则需要延长包被时间。具体时间可根据实验安排确定,本实验采用4℃包被过夜的方法进行包被。
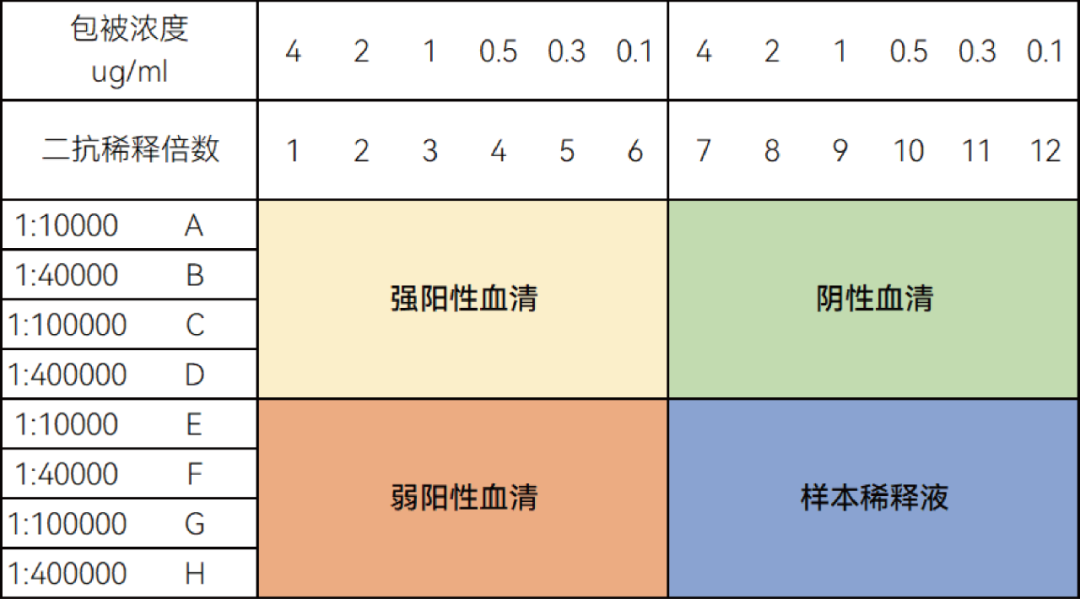
1.2 最佳包被量和二抗浓度筛选
本实验通过棋盘法,对包被量和二抗浓度进行筛选,采用不同浓度的包被抗原,另外再对二抗也做不同浓度的稀释,最终根据反应的信噪比和阴性、稀释液信号值确定最佳包被量。二抗浓度的配制主要根据说明书中推荐范围取中间值或文献报道上下稀释数个梯度。
1.3 封闭
抗原或抗体包被完成后,固相载体表面依然存在未被占用的位点,这些位点还可以继续结合抗原或抗体,为了排除这些位点对ELISA后续步骤的干扰,就需要引入一些无关的物质将这些位点占用,这个过程就是封闭。
最常用的办法就是使用惰性蛋白封闭,常见的惰性蛋白可以是0.05-3% BSA、1%明胶、5%脱脂奶粉、10%小牛血清、1-3% Casein、2%山羊血清等,也可购买商品化的含蛋白或不含蛋白的封闭液进行封闭。值得注意的是有些厂商生产的BSA 和山羊血清、小牛血清等血清制品中可能含有较高浓度的相关物种的抗体,在实验中有可能与二抗进行结合从而造成假阳性的情况。本实验通过对BSA、商品化无蛋白封闭液、山羊血清等进行筛选,比对信噪比确定选用商品化无蛋白封闭液作为本次实验的封闭液。
1.4 样本稀释液
样本稀释液理论上讲封闭液是最理想的,但有时候为了节省试剂和操作,可选择PBS、PBST、生理盐水等作为稀释液。本实验选用封闭液作为样本稀释液配制阴、阳性样本。
1.5 孵育时间和条件
抗原-抗体的反应一般都在37℃或室温进行,孵育时酶标板尽量不堆叠以保证同一块板各孔受热均匀。孵育时间封闭一般在1~2h左右,TMB显色5~15min左右,其余实验步骤大多在1小时左右,部分实验也有采用4℃过夜孵育。
1.6 显色液底物选择
显色底物液的选择主要根据酶标二抗的连接酶来确定,目前二抗中常见的连接物主要为辣根过氧化物酶(HRP)和碱性磷酸酶(AP)。在ELISA实验中HRP主要显色底物液为邻苯二胺(OPD)、四甲基联苯胺(TMB)和ABTS。目前常用的为TMB显色液,经酶作用后由无色变蓝色,加1~2M硫酸终止酶反应后变黄色,在450nm波长下读取吸光值。而AP多采用对硝基苯磷酸酯(PNPP)作为底物,产物为黄色的对硝基酚,用NaOH终止酶反应后颜色不变,且黄色可稳定相对较长时间,在405nm 波长下读取吸光值。
1.7 基质最低稀释度考察
最低稀释度一般不作为方法学验证内容,但在方法开发阶段就需确定,以提高分析方法信噪比、减少基质干扰,优化准确度和精密度。主要方法为通过含不同基质的阳性样本与不含基质稀释液的阳性样本信噪比结果进行比对,综合灵敏度和精密度等因素考察,确定基质的最低稀释度。
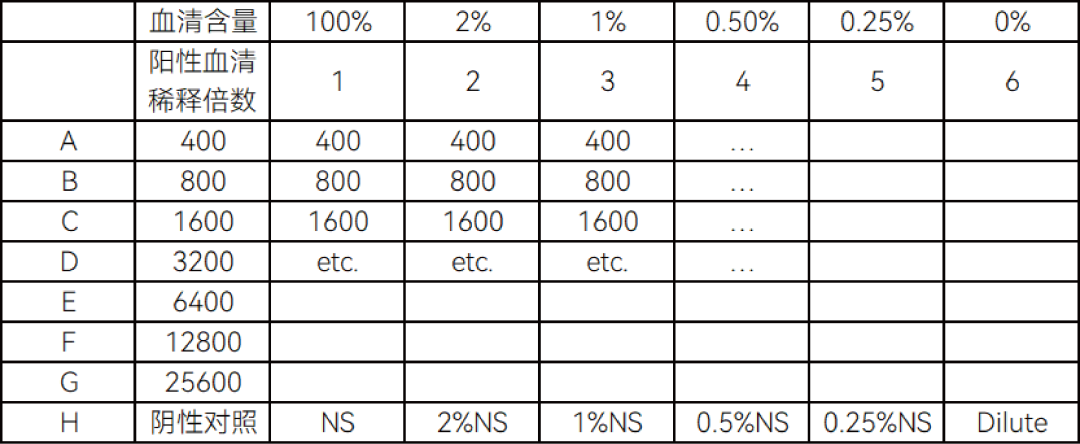
1.8 预验证

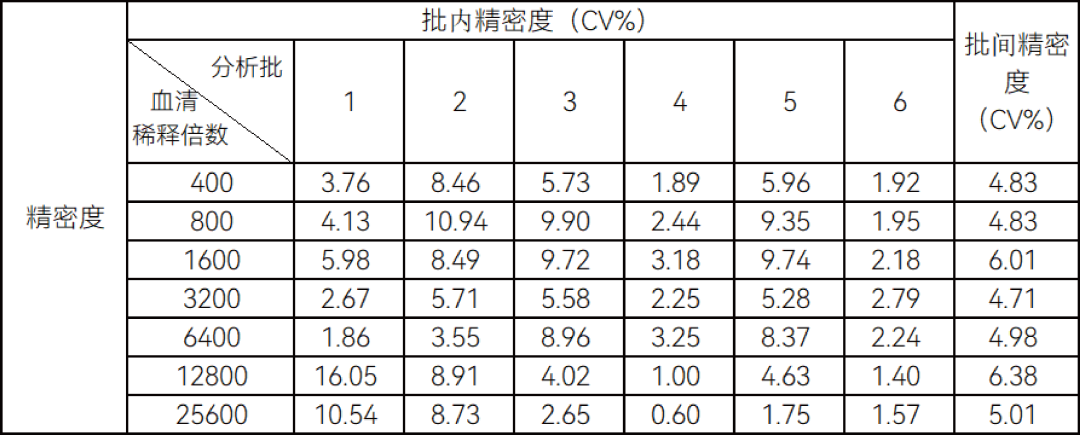
结 语
参考文献:




